Dronedaron, Vareniklin ve Pioglitazona İlişkin FDA ve EMA Değerlendirmeleri
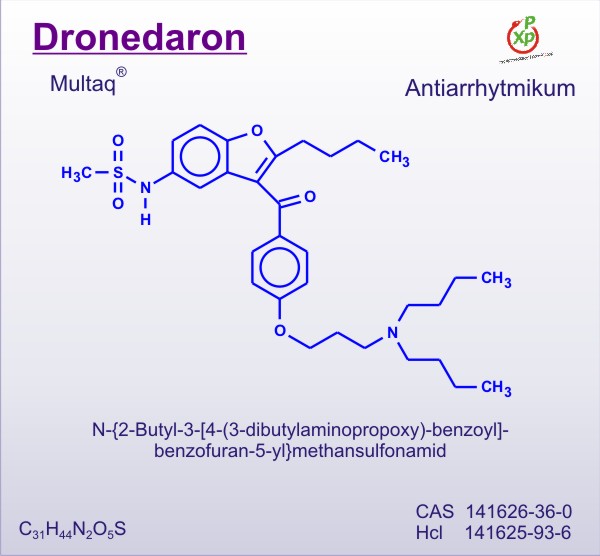
Dronedaron: ABD Gıda ve İlaç Dairesi (FDA) dronedaron ve bu maddenin kardiyovasküler vaka riskinde yol açtığı artışa ilişkin bir güvenlik bildirimi yayınladı. Bildirimde standart tedavinin en üst seviyesinde dronedaron kullanılarak yapılan kalıcı atriyal fibrilasyon sonucu çalışmasını (PALLAS) yeniden ele alarak varılan sonuçlara yer verildi.
Kritik soru, PALLAS çalışmasının kalıcı atriyal fibrilasyon sorunu olan hastalardan alınan olumsuz sonuçlarının, dronedaron içeren ilaçların kullanılabilecekleri, kalıcı olmayan artriyal fibrilasyon gibi onaylı endikasyonları taşıyan hastalara nasıl uygulandığı.
Değerlendirme sonrasında FDA, dronedaronun kullanımının durdurulmasını önermedi. Daha ziyade hastaların Multaq adlı ilacı kullanmaya devam edip etmemeleri hususunda sağlık uzmanlarına danışmaları tavsiyesinde bulundu.
Dronedaron içeren ilaçlara yönelik bu yılın başlarında nadir ancak ciddi karaciğer hasarı için bir güvenlik uyarısı verilmişti. Avrupa İlaç Ajansı (EMA) ise söz konusu maddeye ilişkin olarak PALLAS çalışmasının gözden geçirildiğini ve araştırma sonucunda varılacak nihai kararın Eylül 2011’de duyurulacağını belirtti.
.jpg)
Vareniklin: FDA 16 Haziran’da yaptığı duyuruda kalp damar rahatsızlığı olan hastalarda vareniklin kullanımının bu hastaların kardiyovasküler vaka yaşama riskini az da olsa arttırdığını belirtti. Buna göre vareniklin içeren Chantix adlı sigarayı bırakmaya yardımcı ilacın “Uyarı ve Önlemler” bölümüne konuya ilişkin güvenlik bilgisi ekleneceğini duyurdu.
Buna karşın Avrupa İlaç Ajansı (EMA), vareniklinin bir sigara bıraktırıcı olarak faydasının, riskinden fazla olduğunu ifade etti. Öte yandan, FDA’nın yukarıdaki değinilen uyarıyı dayandırdığı araştırmasının bir takım eksiklikleri olduğunu ve EMA’nın vareniklin üzerine kapsamlı bir analiz yaptığını ve Eylül 2011’de yaptığı çalışmanın sonuçlarını ve tavsiyelerini açıklayacağını belirtti.
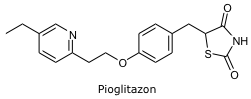
Pioglitazon: EMA Beşeri Kullanım İçin Tıbbi Ürünler Komitesi’nin (CHMP) pioglitazon üzerine yaptığı gözden geçirme çalışmasını tamamladığını ve pioglitazon içeren ilaç kullanan hastalarda mesane kanseri riskinin küçük bir oranda fazla olduğunun tespit edildiğini ifade etti.
Ancak ilacın bazı tip 2 diyabet hastaları için geçerli bir tedavi yöntemi olduğunun bir kez daha doğrulandığını belirtti. Pioglitazonun neden olduğu mesane kanseri artışının, hastanın tedavisinde düzenli aralıklarla ilacın etkililiği ve güvenliğinin denetiminin yapılması koşuluyla uygun hasta seçimi ile bertaraf edilebileceği ifade edildi.
http://blogs.forbes.com/larryhusten/2011/07/21/fda-and-ema-issue-updates-ondronedarone-varenicline-and-pioglitazone/
TEB
Dünyada Ne Var Ne Yok
Temmuz Bülteni