.jpg) Ecz. Ebru CUMBUL
Ecz. Ebru CUMBUL
Farmasötik Biyoteknoloji Bilim Uzmanı
BİYOFARMASÖTİKLER VE BİYOBENZERLER
Günümüzde birçok hastalığın tedavisinde biyoteknolojik ürünler etkin olarak kullanılmaktadır, bu ilaçların çeşitliliği ve kullanım alanları her geçen gün artarak devam etmektedir. 2010 yılında Avrupa’da en çok satan 10 ilaçtan 6’sı biyofarmasötik ürünlerdir.
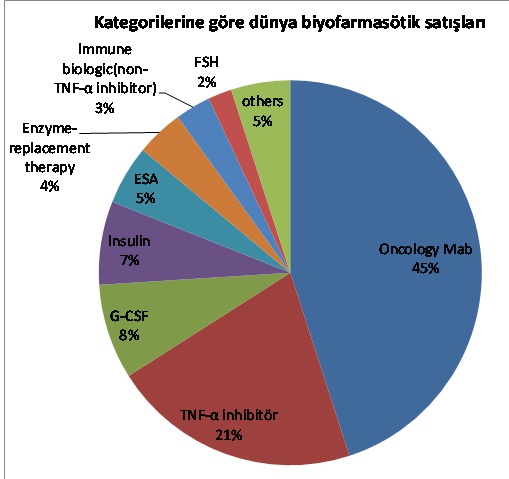
Ref.Biosimilars Advisory Service, Global Pipelines,Regulatory Pathways,and Key Stakeholder Perspectives of Biosimilars March 2013
Biyofarmasötikler(biyolojik /biyoteknolojik ürünler) kimyasal bileşimler yerine biyolojik yöntemlerle (kontrollü gen ekspresyonu, rekombinant DNA teknolojisi, antikor üretim metodları vb) canlı organizmalardan(bitki ve hayvan hücreleri, bakteri. virüs ve mantarlar) elde edilen polipeptid ya da protein yapıda ürünlerdir. Bu ürünler rekombinant proteinler, monoklonal antikorlar, immünolojik tıbbi ürünler, aşılar, kan ürünleri, alerjenler, gen ve hücre tedavisi ürünleridir.
Kimyasal olarak sentezlenen ve şekilleri bilinen ilaçlara karşı çoğu biyolojikler kompleks karışımlardır ve kolayca belirlenemez veya karakterize edilemezler. Konvansiyonel ve biyolojik ilaçlar arasında yapı, etki şekli, üretim metodu, şekil, boyut, vücuda alınım yolları, hatta fiyat ve stoklama koşulları dahil birçok önemli noktada farklılıklar mevcuttur.
Konvansiyonel ve biyolojik ilaçlar arasındaki farklar
.jpg)
Biyoteknolojik ürünler tam olarak kopyalanamayan ürünlerdir. Bu nedenle referans biyoteknolojik ilaçtan esinlenerek üretilen benzer ilaçlar Avrupa İlaç Ajansı (European Medicines Agency- EMA) tarafından biyobenzer ilaç, Dünya Sağlık Örgütü (World Health Organization- WHO) tarafından biyobenzer ürünler, takip eden protein ürünler ya da sonradan piyasaya giren biyolojikler diye adlandırılmaktadır. Bu kuruluşlar tarafından iki ilacın birbirinden farklı olduğu, bu nedenle farklı etki, yan etki ve güvenlik özelliklerinin olabileceği net bir şekilde kabul edilmektedir.
Birçok ülkede biyobenzerler için düzenleyici politikalar geliştirilmiştir ve genelde WHO veya EMA tarafından oluşturulan kılavuzlar izlenmektedir.
EMA’ya göre Avrupa Ekonomik Alanı’nda ruhsatlandırmış olan orijinal bir biyolojik tıbbi ürünün içeriğindeki etkin maddenin bir versiyonunu içeren biyolojik tıbbi ürüne biyobenzer denir. Referans ürünle arasında kalite özellikleri, biyolojik aktivite, güvenlilik ve etkililik bakımından kapsamlı karşılaştırılabilirlilik çalışması yapılmalıdır.
FDA(American Gıda ve İlaç Dairesi) biyobenzeri ABD’de ruhsatlı bir biyolojik ürünle yüksek oranda benzerlik gösteren, klinik açıdan inaktif olan bileşenlerde minör farklara sahip olabilen ve biyolojik ürün ve referans ürün arasında güvenlilik, saflık, ve potens bakımından klinik açıdan anlamlı fark göstermeyen biyolojik ürün olarak tanımlar.
Türkiye’de 2008 yılında “Biyobenzer tıbbi ürünlere ilişkin kılavuz” yayımlanmıştır ve bu sayede biyobenzer ilaçların ruhsatlandırma kriterleri de belirlenmiştir. Ruhsatlı biyolojik referans bir biyolojik ilaca benzerlik gösteren ilaçlara verilen addır. Biyobenzer ürünlerin etkin maddeleri, ilgili biyolojik referans ilaçların etken maddelerinin moleküler ve biyolojik açıdan benzeridir. Biyobenzerler jenerik ürün olarak kabul edilemezler. Bunun nedeni biyoteknolojik ürünlerin canlı organizmalar tarafından üretilmekte olup, kimyasal ilaçlar gibi öngörülür olmamasıdır. Biyobenzer ve biyolojik referans ilaçlar genel olarak aynı güçte aynı hastalığı tedavi etmek amacıyla kullanılır ve farmasötik şekilleri, gücü (dozu) ve uygulama yolları referans ilaç ile aynıdır. Biyobenzer ilaçlar sadece ticari ismi, görünüş ve ambalajlama özellikleri açısından, biyolojik referans ilaçlardan farklılık gösterir.
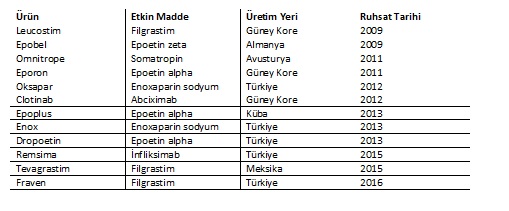
İlk biyobenzer ilaç 2006 yılında piyasaya çıkan EMA onaylı Omnitrop (Somatotropin) (Sandoz)’tur. T.C.Sağlık Bakanlığı onaylı ilk biyobenzer ilaçlar 2009 yılında Epobel(Epoetin zeta)(üretim yeri Almanya,ruhsat sahibi Nobel ) ve Leucostim(Filgrastim)(üretim yeri Güney Kore,ruhsat sahibi Dem İlaç)’tır. 06.03.2015 tarihinde ABD’de FDA tarafından ilk biyobenzer ürün onaylanmıştır: etken maddesi filgrastim olan Zarxio, Sandoz tarafından lisanslıdır. Zarxio, 1991 yılında Amgen tarafından lisanslı Neupogen’in biyobenzeridir
Ülkemizde biyoteknolojik ürünler olan; immünolojik ürünler, recombinant DNA teknolojisi ürünleri,hibridoma teknolojisi ile elde edilen ürünler, monoklonal antikorlar, kan ürünleri, ileri tıbbi tedavi ürünlerinin ruhsatlandırma işlemleri 02.11.2011 tarihinde Resmi Gazete’de yayımlanan 663 sayılı Kanun Hükmünde Kararname ile hâlihazırda Türkiye İlaç ve Tıbbi Cihaz Kurumu Biyolojik ve Biyoteknolojik Ürünler Birimi tarafından gerçekleştirilmektedir.
Türkiye’de Ruhsatlandırılmış Biyobenzerler
Biyobenzerler ile ilgili spesifik problemler; immunojenisite, güvenlilik(farmakovijilans), extrapolasyon, otomatik değiştirme(yerine koyma) ve maliyettir.
İmmunojenisite vücuda giren immünojenin immün yanıtı tetikleyerek antikor oluşturma riskidir. Antikor oluşumu sonucunda ortaya çıkabilecekler ise; yan etki veya etkisizlik olabilir. İmmunojenisite preklinik çalışmalar ile öngörülemez ve spesifik hedef populasyonda klinik olarak değerlendirilmelidir.
Farmakovijilans; advers etkilerin ve beşeri tıbbi ürünlere bağlı diğer muhtemel sorunların (suistimal, zehirlenme, etkisizlik) saptanması, değerlendirilmesi, tanımlanması ve önlenmesi ile ilgili bilimsel çalışmalardır. Hem orijinal ürün hem de biyobenzer için onay alındıktan sonra da devam etmesi gerekli süreklilik arzeden bir basamaktır. Tüm biyolojik ajan üretici firmaları (biyobenzer üreticileri de dahil) post-marketing güvenlik izlem programı ve yan etki bildirimi gibi konuların takibi açısından primer sorumludur.
Herhangi bir endikasyonda gerekli deneylerle etkililiğini kanıtlamış bir biyobenzerin, ek klinik araştırmalara ihtiyaç duymadan başka bir endikasyonda kullanım izni almasına 'ekstrapolasyon' denir. “Extrapolation” ile birçok endikasyonda çalışma yapma şartı ortadan kalktığı için ilaç maliyetinde belirgin düşüş sağlanabilir. Fakat bir ajan belirli bir endikasyon için güvenilir ve etkili iken, bir başka endikasyonda aynı etkinliği gösteremeyebilir.
Biyoteknolojik ilaçlar özdeş olmadığı için değiştirme kuralları biyobenzerlere uygulanamaz. Değiştirilebilirlik; bir ilacın, eşdeğer olduğu kanıtlanmış bir diğer ilacın yerine kullanılabileceğini gösteren bir ifadedir. Değiştirilebilirlik için bilimsel kanıt ve sağlık otoritesi onayı gereklidir. Jenerik ürünlerin, orijinal ürünler ile değiştirilebilir olduğu tüm dünyada kabul edilmektedir. Biyobenzerlerde değiştirilebilirlik için henüz rehber düzeyinde bir bilimsel kanıt olmadığından genelde öneri bazında değerlendirilmektedir. Değiştirilebilirliğin immunojenisite üzerine net etkisinin ne olduğu/olacağı da henüz açık kapılardan birisidir.
Biyobenzer üreticileri, orijinal ilacın üretimindeki bir takım basamakları otomatik olarak atlamasına rağmen (faz II çalışmaya gerek olmaması, her zaman hayvan çalışmalarının gerekli olmaması gibi) halen üretim maliyeti açısından hedefe ulaşabilmiş değildir.
Dünya ilaç pazarındaki yeri gittikçe artan biyoteknolojik ilaçların Türkiye’deki üretimine yönelik çalışmalar başlamıştır.2015 yılında Türkiye ilaç pazarında satışta olan 183 adet referans biyoteknolojik ürünün hepsi ithal edilirken,38 biyobenzer ilaçtan 13 tanesinin üretimi ülkemizde yapılmaktadır (Türkiye Cumhuriyeti Ekonomi Bakanlığı, İlaç ve Eczacılık Ürünleri Sektör Raporları,2016). Türkiye İlaç ve Tıbbi Cihaz Kurumu Başkanı Osman Nacar 6 Mayıs 2016 tarihinde ‘Kurumumuzca hali hazırda toplam 33 adet biyobenzer ürün bulunmaktadır. Söz konusu ürünlerin 15’i imal,18’i ithaldir. İmal ruhsatnamesi bulunan bu ürünlerden 14’ü etken madde üretim aşamaları yurt dışında gerçekleşen, ülkemizde ise dolumu, primer ve sekonder ambalajlama işlemlerinin yapıldığı ürünlerdir.’ diye açıklama yapmıştır(Anadolu Ajansı). Etkin maddenin hücreden itibaren tüm üretim aşamalarının Türkiye’de gerçekleştirilerek üretildiği tek biyobenzer ilaç bulunmaktadır. Bu ilaç Arven ilacın ürettiği Filgrastim etken maddeli Fraven’dir.
Türkiye’nin dışa bağımlılığını azaltan, ekonominin gelişimini hedefleyen yatırımlar ve sektörde Ar-Ge ye ve üretime yönelik yatırımcılara teşvikler yapılmalıdır.