Uzm. Ecz. Ayşe Arık
‘’Ön saflarda çalışan biz sağlık profesyonellerine; aşıların güvenliği ve etkinliği konusunda hastalara danışmanlık verilmesi ve aşılama sonrası izleme konularında kritik ihtiyaç duyulmaktadır.’’
Bu sebeple COVID-19 salgınında öncelikle varyantları ardından da aşıları yakından tanımamız gerekir.
Dünya Sağlık Örgütü'nden (WHO) Dr. Soumya Swaminathan, geçtiğimiz günlerde yaptığı açıklamada varyantlar hakkında şunları söyledi:
“Yılın başından beri bu virüsü izliyoruz ve birçok mutasyona uğradığını biliyoruz. Virüsün kendi içinde mutasyonunun gelişimi beklenen bir durumdur, ancak çok sayıda mutasyon içeren yeni varyantlardan ikisi, Aralık ayından itibaren dikkatimizi çekti. Endişemizin nedeni ise, bu varyantların her ikisinin de ortaya çıktıkları Birleşik Krallık ve Güney Afrika'daki vaka sayısındaki artışla ilişkili olmasıdır.’’
Varyantlarda en önemli durum; koronavirüse taç benzeri görünümünü veren başak proteinlerinde önemli değişiklikler olmasıdır. Bu proteinler virüsün arama kartıdır; yani bağışıklık sisteminin enfeksiyon sırasında kendini koruduğu ve enfeksiyondan sonra tanıdığı birincil antijendir. Aynı zamanda çoğu aşının ana hedefidir.
VARYANTLAR
Wuhan veya orijinal varyant.
Çin'in Wuhan kentinde ortaya çıkan tespit edilecek ilk tür. Bilim insanları tarafından kısaca G mutasyonu olarak adlandırılan bu mutasyon, 2020’nin Ocak ayında, Çin’de keşfedildi. Kısa süre sonra dünyaya yayılarak pandemiye dönüştü. Bilim insanlarının geçtiğimiz Temmuz ayında veri tabanına yüklediği 50 bin koronovirüs genomunda yüzde 70’inin orijinal varyantı taşıdığı açıklandı.
İngiltere
B.1.1.7 olarak adlandırılan Birleşik Krallık varyantı ilk olarak 2020 sonbaharında tanımlandı. CDC'ye göre diğer varyantlardan daha kolay ve hızlı yayılır gözlemlendi. Potansiyel olarak orjinal tip versiyondan yaklaşık %50 daha bulaşıcı olduğu düşünülmektedir. İlk vaka ABD'de 2020 Aralık sonunda tespit edildi. 50’den fazla ülkeye yayıldığı bilinmektedir.
Güney Afrika
501Y.V2 olarak adlandırılan varyant, İngiltere’den bağımsız olarak ortaya çıktı ve ilk olarak Güney Afrika'da Ekim 2020'nin başlarında tespit edildi. Virüsün başak proteini, yaklaşık 20 derece dönerek hücrelere daha sıkı bağlanmasını ve daha bulaşıcı olmasını sağladı. İngiltere suşu ile benzer özellikleri var. ABD'deki vakalar ilk olarak 2021 Ocak ayının sonunda bildirildi. 14 ülkeye yayıldığı bilinmektedir. Şu anda, çoğu uzmanı en çok ilgilendiren varyanttır, çünkü mevcut aşılara ve antikor tedavilerine daha az yanıt veriyor gibi görünmektedir.
ABD Ulusal Alerji ve Enfeksiyon Hastalıkları Enstitüsü ‘nün başında olan Anthony S. Fauci Ocak ayında yaptığı açıklamada, “Aşıların bu varyantlara karşı etkisi azalmış olabilir, ancak muhtemelen etkili olmaya devam edecekler” dedi.
Pfizer ve BioNTech, aşılarının Güney Afrika ve İngiltere varyantında etkili olduğunu öne sürdü. Johnson & Johnson, aşısının küresel denemede güçlü bir şekilde etkili olduğunu, ancak hastalığa karşı korumasının Güney Afrika varyantında daha zayıf olduğunu söyledi.
Brezilya
20J/501Y.V3 olarak adlandırılır ve ilk olarak Ocak ayının başlarında Japonya'da rutin testler sırasında Brezilya'dan seyahat eden kişilerde tanımlanmıştır. CDC'ye göre, antikorlar tarafından tanınabilme yeteneğini etkileyen bir grup ek mutasyona sahip gibi görünüyor. İlk vaka ABD'de 2021 Ocak ayının sonunda gözlemlendi. Moderna, gerekli olması durumunda, bu varyanta özel olarak tasarlanmış yeni bir aşı geliştireceğini duyurdu.
E484K
Mutasyonun içindeki mutasyon ya da vücudun bağışıklık savunmasını geçmesine yardımcı olduğu için kaçış mutasyonu olarak adlandırılır. Bağışıklıktan kurtulmada daha iyi olan daha hızlı yayılan bir virüs kombinasyonu endişe vericidir, eğer durdurulmazsa İngiltere varyantını geride bırakacaktır. Mevcut aşılar bu mutasyonu kapsamayan virüsler için yapılmıştır. Aşı firmaları influenza aşılarında olduğu gibi her yıl güncellenen ve mutasyonlu formları da kapsayan tek dozluk aşılar üretmeye çalışmaktadır.
New York
B.1.526 olarak adlandırılan bu varyant, ilk olarak New York'ta ve daha sonra ara sıra kuzeydoğuda ortaya çıktı. Mutasyonlardan biri, Güney Afrika varyantında görülene benzer. Bununla ilgili veriler 25 Şubat 2021 itibariyle hakem incelemesine tabi tutulmuştur.
California
Los Angeles'ta, ilk olarak Temmuz ayında bir vakada tespit edilen ve Ekim ayına kadar tekrar görülmeyen CAL.20C suşu, Aralık'taki tüm vakaların üçte birinden fazlasını oluşturuyordu. Varyantın yayılması, bölgedeki ani vaka artışıyla aynı zamana denk geldi. Kuzey Kaliforniya ve Avrupa'da hızla yayılan başka bir suşla paylaştığı L452R adı verilen de dahil olmak üzere beş yinelenen mutasyonu içerir.
AŞILAR
Pfizer-BioNTech / BNT162b2
Pfizer-BioNTech COVID-19 aşısı, 20 Kasım’da Acil Kullanım İzni (EUA) için FDA'ya gönderildi ve 11 Aralık'ta onaylandı. Virüsün başak proteinini kodlayan ve bir lipit içinde kapsüllenen bir mRNA aşısıdır. Enjekte edildikten sonra hücreler, vücudun bağışıklık sistemini virüsü tanıması için tetikleyerek başak proteinini çıkarır. Faz III denemelerinde, %95 etkinlik göstermiştir, özel dondurucu gerektirir.
Tür: mRNA, 16 yaş üzeri
Dozlar: 2 doz, 21 Gün ara, ikinci dozdan sonra 7. günde etki
Fiyat: İlk 100 milyon doz için doz başına 19,50 ABD doları
Etkinlik: Yaklaşık %95. Görünüşe göre hastaneye yatmayı ve ölümü önlemede %100.
Yan etkiler: Lokal ve sistemik yan etkiler doza bağımlı ve ikinci dozdan sonra nispeten yaygın; çoğu hafif veya orta şiddette. En yaygın enjeksiyon bölgesi reaksiyonları (%84,1), yorgunluk (%62,9), baş ağrısı (%55,1), kas ağrısı (%38,3), titreme (%31,9), eklem ağrısı (%23,6) ve ateştir (%14,2); katılımcıların %0 ila %4,6'sında şiddetli advers reaksiyonlar meydana geldi, doz 2'den sonra yan etkiler daha şiddetli görülebilir.
Varyantlar: Laboratuar verileri, Birleşik Krallık varyantının yanı sıra Güney Afrika ve Latin Amerika varyantlarına karşı " etkili" olduğunu göstermektedir.
Sinovac Biyoteknoloji /CoronaVac
13 Ocak 2021'de, Çin merkezli Sinovac Biotech, COVID-19 aşısının Brezilya'daki son aşama klinik çalışmalarda %50,38 etkinliğe sahip olduğunu bildirdi. Şirketin klinik deneyleri, önemli ölçüde değişen etkinlik oranları ortaya koymaktadır. Endonezya'da, yerel bir deneme %65'lik bir etkinlik oranı gösterdi, ancak denemede yalnızca 1.620 katılımcı vardı. Türkiye, Aralık 2020'de %91,25'lik bir etkinlik oranı bildirdi. Brezilya'da yerel bir ortak olan Butantan Enstitüsü tarafından yürütülen bir başka çalışma, geçen hafta hafif vakalarda %78, şiddetli ve orta derecede enfeksiyonlara karşı %100'lük bir etkinlik oranı bildirdi. İnaktive edilmiş SARS-CoV-2 virüslerini kullanan inaktive edilmiş bir aşıdır.
Tür: Aktif olmayan SARS-CoV-2 virüsü, 18 yaş üzeri
Dozlar: 2 doz, 21 gün ara
Fiyat: Çin'de doz başına 60 dolar sonrasında doz başına 29,75 dolar
Etkinlik: Klinik araştırmaya bağlı olarak %50,38 ila %91,25
Yan etkiler: Faz I ve II çalışmaları sonucuna göre, en sık görülen yan etki enjeksiyon bölgesinde ağrı (%17). Bunun dışında görülen yan etkiler; aşı uygulanan bölgede şişlik, kızarıklık, yorgunluk, hafif ateş, titreme, baş ağrısı, kas, eklem ağrısı, kusma ve ishal
Varyantlar: Bilinmiyor, ancak Brezilya'da yapılan bir çalışma semptomatik enfeksiyonları önlemede %50,4 etkinlik
Moderna / mRNA-1273
16 Kasım'da Moderna, COVID-19 aşısından bir ön veri çıktısı yayınlayarak %94,5'lik bir etkinlik oranına işaret etti. 19 Aralık'ta FDA tarafından yetkilendirildi. Pfizer-BioNTech aşısı gibi, bir mRNA aşısıdır. Ancak bu aşının aksine, Moderna aşısı 2 ila 8 C’de 30 güne kadar stabildir ve -20 C'de altı aya kadar saklanabilir.
Tür: mRNA, 18 yaş üzeri
Dozlar: 2 doz, 28 Gün ara, İkinci dozdan sonra 14. Günde etki
Fiyat: Doz başına 25- 37 ABD Doları
Etkinlik: Yaklaşık %95. Görünüşe göre hastaneye yatmayı ve ölümü önlemede %100.
Yan Etkiler: En yaygın advers reaksiyonlar enjeksiyon bölgesinde ağrı (% 91,6), yorgunluk (% 68,5), baş ağrısı (%63,0), kas ağrısı (% 59,6), eklem ağrısı (% 44,8) ve titreme (% 43,4). İstenmeyen reaksiyonlar doz 2'den sonra daha sıktır
Varyantlar: Laboratuar verileri, Birleşik Krallık varyantının yanı sıra Güney Afrika ve Latin Amerika varyantlarına karşı "etkili" olduğunu göstermektedir.
 Janssen (Johnson ve Johnson) / Ad26.COV2.S
Janssen (Johnson ve Johnson) / Ad26.COV2.S
15 Kasım'da Janssen, COVID-19 aşısının ikinci bir küresel Faz III denemesini başlattığını duyurdu. Diğer üç aşının tümü yaklaşık 28 gün arayla iki doza ihtiyaç duyarken, J&J aşısı yalnızca tek dozdur. Faz I / II denemesinin ara sonuçları, tek bir aşı dozunun güçlü bir bağışıklık tepkisi uyardığını ve genellikle iyi tolere edildiğini gösterdi. ENSEMBLE 2 çalışması, iki dozluk bir rejimi de değerlendirdi.
Faz III ENSEMBLE denemesi, tek dozluk aşının, aşılamadan 28 gün sonra orta ila şiddetli COVID-19'u önlemede genel olarak %66 etkili olduğunu gösterdi. Bununla birlikte, 49. günden sonra şiddetli hastalığı önlemede %100 etkinlik gösterdi.
Aşı, şirketin onaylı Ebola aşısını ve Zika, RSV ve HIV araştırma aşısı adaylarını geliştirmek için kullandığı AdVac teknoloji platformunu kullanıyor, aşı tasarımı etkisizleştirilmiş bir soğuk algınlığı virüsünün kullanımı etrafında şekilleniyor.
13 Nisan'da, CDC ve FDA, J&J (Janssen) COVID-19 aşısının kullanımında geçici bir ara vermeyi tavsiye etti. Ulusal olarak uygulanan 6.8 milyon dozdan, aşılamadan 6 ila 13 gün sonra ortaya çıkan semptomlarla birlikte, düşük kan trombosit seviyeleri (trombositopeni) ile birlikte görülen, serebral venöz sinüs trombozu adı verilen nadir ve şiddetli bir kan pıhtısı türü bildirilen 6 vaka vardır. Bildirilen bu vakaların tümü 18 ile 48 yaşları arasındaki kadınlardı. Bu spesifik kan pıhtısı tipinin tedavisi, tipik olarak uygulanabilecek tedaviden farklıdır. Genellikle, antikoagülan ilaç olan heparin, kan pıhtılarını tedavi etmek için kullanılır. Bu durumda, heparin uygulaması tehlikeli olabilir ve alternatif tedavilerin verilmesi gerekir. CDC, bu vakaları daha ayrıntılı incelemek ve potansiyel önemini değerlendirmek için 14 Nisan'da Aşılama Uygulamaları Danışma Komitesi toplantısı düzenledi. Komite, halen gelen güvenlik raporlarını analiz ettiği için aşının mevcut "duraklatıldı" durumunu değiştirmedi ama 23 Nisan'dan sonra dağıtıma devam etmek için bir tavsiyede bulunması bekleniyor.
Tür: Adenovirüs bazlı, 18 yaş üzeri
Dozlar: Tek doz, 14 gün sonra etki ya da 2 doz 56 gün arayla
Fiyat: Doz başına 10 ABD doları
Etkinlik: J & J’nin küresel klinik denemesinde, semptomatik COVID-19 enfeksiyonlarını önlemede %66 etkinlik gösterdi. ABD'de %72 ile biraz daha yüksek etkinlik vardı. Hastaneye yatışları ve ölümleri önlemede %100 etkili olduğu görülmektedir.
Yan Etkiler: Aşı olanlarda enjeksiyon bölgesinde ağrı (%49), baş ağrısı (%39), yorgunluk (%38) ve miyalji (%33) bildirilmiştir; %2'den azı derece 3 sistemik yan etki bildirdi. Aşılamanın ardından %9'unda ateş ortaya çıktı. Bu yan etkiler, 59 yaş ve altındaki kişilerde daha yaygındı. Aşılananlarda, plasebo alıcılara kıyasla daha fazla ürtiker (5'e 1), tromboembolik olaylar (15'e 10) ve tinnitus (6'ya karşı 0) vakası görülmüştür.
Varyantlar: Afrika, İngiltere ve Latin Amerika'daki klinik çalışmalara dayanarak, aşının Güney Afrika ve Latin Amerika suşlarına karşı daha az etkili olmasına rağmen varyantlara karşı etkili olduğuna dair kanıtlar vardır.
AstraZeneca-Oxford Üniversitesi / AZD1222
İngiltere ve Brezilya'daki denemelerde birleşik analiz, %70'lik ortalama etkinlik gösterdi. AstraZeneca aşısı, normal soğutulmuş koşullarda, yaklaşık 2-8 C'de en az altı ay süreyle saklanabilir, taşınabilir ve kullanılabilir ve mevcut sağlık bakımı ortamlarında uygulanabilir.
25 Mart 2021'de AstraZeneca, aşının 65 yaş ve üstü kişilerde semptomatik COVID-19'a karşı %76, şiddetli veya kritik hastalıklara ve hastaneye yatışlara karşı %100 etkinlik gösterdiğine dair birincil analizi yayınladı. Vaccitech'in teknolojisini kullanıyor.
AstraZeneca ve Oxford Üniversitesi tarafından geliştirilen COVID-19 aşısı, pulmoner emboli, derin ven trombozu (DVT) veya trombositopeni ile ilişkilendirilmiştir. Sonuç olarak, bir düzineden fazla Avrupa ülkesi AstraZeneca-Oxford aşısının dağıtımını durdurdu. Bugüne kadar, Avrupa'da 34 milyon aşıdan AstraZeneca-Oxford aşısına bağlı 30'dan fazla ölümle birlikte yaklaşık 222 şüpheli kan pıhtılaşma vakası olmuştur.
Tür: Adenovirüs bazlı, 18 yaş üzeri
Dozlar: 2 doz, 28 Gün ara ile
Fiyat: AB'de 2,15 ABD doları; Birleşik Krallık ve ABD'de 3-4 ABD Doları; Güney Afrika'da 5,25 ABD Doları
Etkinlik: Şu anda genel olarak yaklaşık %70
Yan etkiler: Olası kan pıhtı problemleri dolayısıyla aşılama durduruldu.
Varyantlar: Güney Afrika varyantına karşı çok az etkiye sahip olduğunu, ancak İngiltere ve Brezilya varyantlarına karşı ‘’etkili’’göründüğünü ortaya koydu.
Rusya Sputnik V
 11 Kasım civarında, Rusya Ulusal Epidemiyoloji ve Mikrobiyoloji Araştırma Merkezi (Faz III denemesine başlamadan önce) ikinci dozdan sonra %92'lik bir etkinlik oranına sahip olduğunu iddia etti. Devam eden Faz III çalışması sırasında ilk enjeksiyondan 21 gün sonra yapılan ilk ara analize dayanıyordu. 24 Kasım'da organizasyon, yeni ön verilere dayanarak %95 etkinlik iddia etti. 14 Aralık 2020'de %91,4 etkinlik bildirdiler. Ayrıca, AstraZeneca aşısının etkinliğini artırmak için iki insan adenoviral vektöründen birini AstraZeneca ile paylaşmayı teklif etti.
11 Kasım civarında, Rusya Ulusal Epidemiyoloji ve Mikrobiyoloji Araştırma Merkezi (Faz III denemesine başlamadan önce) ikinci dozdan sonra %92'lik bir etkinlik oranına sahip olduğunu iddia etti. Devam eden Faz III çalışması sırasında ilk enjeksiyondan 21 gün sonra yapılan ilk ara analize dayanıyordu. 24 Kasım'da organizasyon, yeni ön verilere dayanarak %95 etkinlik iddia etti. 14 Aralık 2020'de %91,4 etkinlik bildirdiler. Ayrıca, AstraZeneca aşısının etkinliğini artırmak için iki insan adenoviral vektöründen birini AstraZeneca ile paylaşmayı teklif etti.
2 Şubat 2021'de The Lancet, virüsün orijinal suşuna karşı %91,6'lık bir etkinlik gösteren Faz III verilerini yayınladı.
Tür: Adenovirüs bazlı, 18 yaş üzeri
Dozlar: 2 doz, 21 gün arayla
Fiyat: Doz başına 10 ABD doları
Etkinlik: %91,6
Varyantlar: Bilinmiyor. Klinik çalışma verileri büyük ölçüde, ana varyantların ortaya çıkmasından önce Rusya'da gerçekleştirildi.
Novavax
28 Ocak 2021'de Novavax, COVID-19 aşısı NVX-CoV2373'ün Birleşik Krallık'taki Faz III denemesinde %89,3'lük bir aşı etkinliğine ulaştığını duyurdu. Aşı, protein bazlı bir COVID-19 aşı adayıdır. Aynı zamanda Güney Afrika Faz IIb denemesinden ve çeşitli Faz I, II ve III denemelerinden de verilere sahiptir. İngiltere ve Güney Afrika varyantlarına karşı da yüksek klinik etkinlik göstermiştir.
Aşı, şirketin rekombinant nanopartikül teknolojisi ve tescilli saponin bazlı Matrix-M adjuvanı kullanılarak yapılan tam uzunlukta bir prefüzyon spike proteini içerir. 2-8 derece C arasında stabildir ve kullanıma hazır sıvı formülasyon içinde sevk edilir.
Tür: Protein bazlı aşı, 18 yaş üzeri
Dozlar: 2 doz
Fiyat: ABD'de 16 dolar
Etkinlik: %89,3
Varyantlar: İngiltere ve Güney Afrika'ya karşı etkilidir.
CanSino Biologics
CanSino Biologics aşısı, Çin ordusu ile birlikte geliştirildi. Semptomatik vakaları önlemede etkililik oranı %65,7'dir. Bu, ilk olarak 8 Şubat 2021'de Pakistan'ın sağlık danışmanı Faisal Sultan tarafından Twitter'da yayınlanan çok ülkeli bir analize dayanmaktadır. Faz III denemesi 30.000 katılımcıyı içermektedir ve ciddi hastalıkları önlemede %90,98 etkinlik göstermiştir. Meksika'ya 35 milyon doz tedarik etmeyi kabul etti ve 3.5 milyon doz için Malezya ile görüşüyor. Pakistan en büyük denemelerden birini yürütüyor ve 20 milyon için sözleşme imzaladı. Ayrıca Covax programı aracılığıyla aşının onaylanması için WHO ile birlikte çalışıyor. Ayrıca Rusya'nın Sputnik V aşısının ikinci dozunun CanSino ile değiştirilmesinin aynı veya daha iyi koruma sağlayıp sağlamayacağını belirlemek için Rusya ile bir deneme planlıyor.
CanSino Biologics, enjeksiyon yerine solunan deneysel bir COVID-19 aşısının klinik denemelerini başlatacağını duyurdu. Sonuç olarak, Çin hükümeti ülkedeki aşı etkinliğini artırmak için alternatif aşılar düşünüyor. Şubat ayında yapılan bir denemede aşı, semptomatik vakaları önlemede %65,7'lik bir etkinlik gösterdi. Ancak Nisan ayında şirket, etkinlik oranının zamanla düştüğünü, ancak aşılamadan sonra %50 veya daha fazla bir orana sahip olması gerektiğini belirtti.
Tip: Viral vektör, SARS-CoV-2 virüsünden bir antijeni bir adenovirüse yükler, 18 yaş üzeri
Dozlar: Tek doz
Fiyat: Bilinmiyor
Etkinlik: Semptomatik vakaları önlemede %65,7; Şiddetli hastalığı önlemede %90,98 etkinlik.
Varyantlar: Bilinmiyor.
Bharat Biyoteknoloji / Covaxin
22 Nisan 2021'de, Hintli Bharat Biotech, şiddetli enfeksiyona karşı %100 etkinlik gösteren COVID-19 aşısı Covaxin'in III. Aşama denemesinin ara verilerini bildirdi. Aşı, Hindistan Tıbbi Araştırma Konseyi'nin (ICMR) Ulusal Viroloji Enstitüsü'nden tohum türleriyle geliştirildi. Oldukça saflaştırılmış ve inaktive edilmiş bir aşıdır. Sıfırın altında saklama, sulandırma gerektirmez ve çok dozlu flakonlarda kullanıma hazır sıvı, 2-8 C derecede stabildir.
Tür: Tüm Virion Etkinleştirilmemiş Vero Hücre platform teknolojisi kullanılarak devre dışı bırakılmış SARS-CoV-2 virüsü, 18 yaş üzeri
Dozlar: 2 Doz, 28 gün arayla
Fiyat: yaklaşık 2 $ (ABD),
Etkinlik: Şiddetli enfeksiyona karşı %100; Hafif, orta ve şiddetliye karşı %78; Asemptomatiklere karş %70
Varyantlar: Wildtype; İngiltere varyantını etkisiz hale getirebilir.
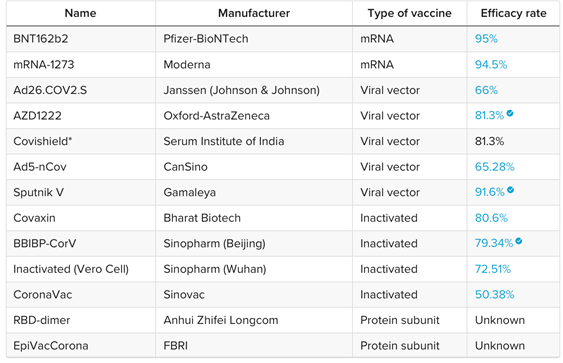
Bunların yanı sıra RBD-dimer, EpiVacCorona adıyla iki protein subunit aşı çalışması da devam etmektedir. Ayrıca birçok ülke de aşı çalışmalarına hız vermiştir. Aşağıdaki tabloda da genel olarak aşıları görmektesiniz.
Tüm dünyayı etkisi altına alan pandemi sürecinin aşılanma ile yenileceği açıkça ortadadır. Bizler eczanelerimizde aşılama konusunda toplumu bilgilendirmede büyük rol oynuyoruz. Tüm aşılar ve varyantlar hakkında genel bir bilgi oluşturabilmek için yazdığım bu yazı umarım faydalı olur.
Sağlıklı günlerde görüşmek dileğiyle…
Fiyatlandırma hakkında not: Listelenen fiyatlar, çoğunlukla aşıların ilk çıktığı tarihte orijinal olarak yayınlanan fiyatlardır. Çeşitli hükümetler tarafından yapılan çoklu sözleşmeler ve bunların geri ödenme şekli nedeniyle, fiili fiyatlarda önemli değişkenlikler,ülkeden ülkeye fiyatlandırmada önemli farklılıklar olabilir.
KAYNAKLAR :
1-World Health Organization. Draft landscape and tracker of COVID-19 candidate vaccines. www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines. Accessed January 12, 2021.
2. FDA. Emergency Use Authorization (EUA) of the Pfizer-BioNTech COVID-19 vaccine to prevent COVID-19. Revised February 25, 2021. Fact sheet for healthcare providers administering vaccine. www.fda.gov/media/144413/download. Accessed March 29, 2021.
3. FDA. Emergency Use Authorization (EUA) of the Moderna COVID-19 vaccine to prevent COVID-19. Fact sheet for healthcare providers administering vaccine. Revised December 2020. www.fda.gov/media/144637/download?utm_medium=email&utm_source=govdelivery. Accessed January 10, 2021.
4. FDA. Emergency Use Authorization (EUA) of the Janssen COVID-19 vaccine to prevent COVID-19. Factsheet for healthcare providers administering vaccine. Revised February 27, 2021. www.fda.gov/media/146304/download. Accessed March 5, 2021.
5. FDA. Vaccines and Related Biological Products Advisory Committee meeting December 10, 2020. FDA briefing document: Pfizer-BioNTech COVID-19 vaccine. www.fda.gov/media/144245/download. Accessed March 5, 2021.
6. FDA. Vaccines and Related Biological Products Advisory Committee meeting December 17, 2020. FDA briefing document: Moderna COVID-19 vaccine. www.fda.gov/media/144434/download. Accessed March 5, 2021.
7. Dooling K, McClung N, Chamberland M, et al. The Advisory Committee on Immunization Practices’ interim recommendation for allocating initial supplies of COVID-19 vaccine—United States, 2020. MMWR Morb Mortal Wkly Rep. 2020;69(49):1857-1859.
8. ACIP COVID-19 Vaccine Working Group. Phased allocation of
COVID-19 vaccines. December 20, 2020. www.cdc.gov/vaccines/acip/
meetings/downloads/slides-2020-12/slides-12-20/02-COVID-Dooling-508.pdf. Accessed March 16, 2021.
9. Polack FP, Thomas SJ, Kitchin N, et al. Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccine. N Engl J Med. 2020; 383:2603-2615.
10. Widge AT, Rouphael NG, Jackson LA, et al. Durability of responses after SARS-CoV-2 mRNA-1273 vaccination. N Engl J Med. 2020; 384(1):80-82.
11. Walsh EE, Frenck RW Jr, Falsey AR, et. al. Safety and immunogenicity of two RNA-based Covid-19 vaccine candidates. N Engl J Med. 2020;383:2439-2450.
12. FDA. FDA briefing document. Janssen Ad26.COV2.S vaccine for the prevention of COVID-19. Vaccines and Related Biological Products Advisory Committee meeting, February 26, 2021. www.fda.gov/media/146217/download. Accessed March 5, 2021.
13. CDC. Clinical considerations for use of COVID-19 vaccines currently authorized in the U.S. Revised March 5, 2021. https://www.cdc.gov/vaccines/covid-19/info-by-product/clinical-considerations.html. Accessed March 29, 2021.
14. American College of Obstetricians and Gynecologists’ (ACOG) Immunization, Infectious Disease, and Public Health Preparedness Expert Work Group in collaboration with Riley LE, et al. Vaccinating pregnant and lactating patients against COVID-19. Updated March 24, 2021. www.acog.org/clinical/clinical-guidance/practice-advisory/articles/2020/12/vaccinating-pregnant-and-lactating-patients-against-covid-19. Accessed March 29, 2021.
15. CDC. Interim clinical considerations for use of COVID-19 vaccines currently authorized in the United States. Updated March 5, 2021. www.cdc.gov/vaccines/covid-19/info-by-product/clinical-considerations.html. Accessed March 29, 2021.
16. CDC. What to do if you have a severe allergic reaction after getting a COVID-19 vaccine. Updated March 4, 2021. www.cdc.gov/coronavirus/2019-ncov/vaccines/safety/allergic-reaction.html. Accessed March 29, 2021.
17. CDC. Joint CDC and FDA Statement on Johnson & Johnson COVID-19 Vaccine. www.cdc.gov/media/releases/2021/s0413-JJ-vaccine.html. Accessed April 16, 2021.
18.https://www.biospace.com/article/comparing-covid-19-vaccines-pfizer-biontech-moderna-astrazeneca-oxford-j-and-j-russia-s-sputnik-v/
19.https://www.precisionvaccinations.com/vaccines/astrazeneca-covid-19-vaccine-vaxzevria